Den första selektiva allosteriska TYK2-hämmaren1
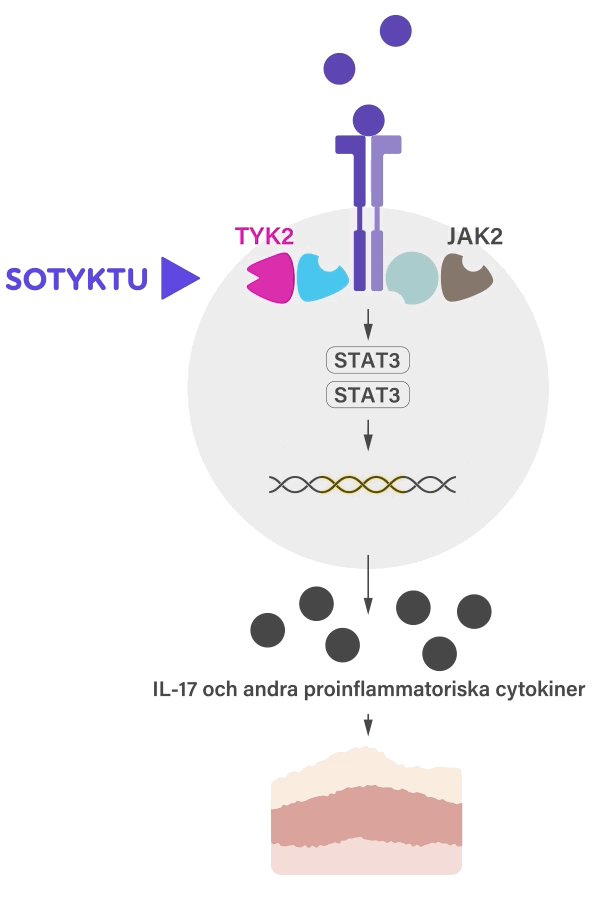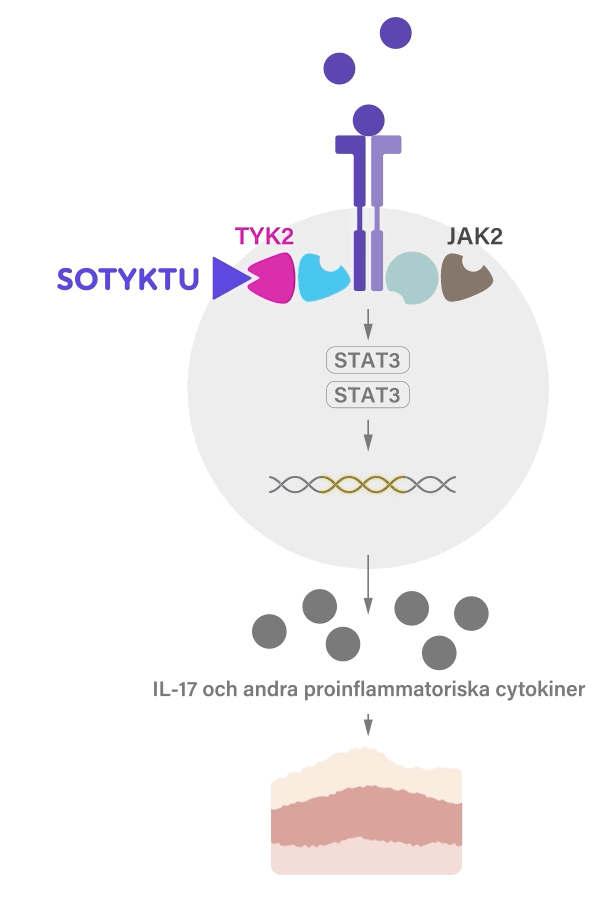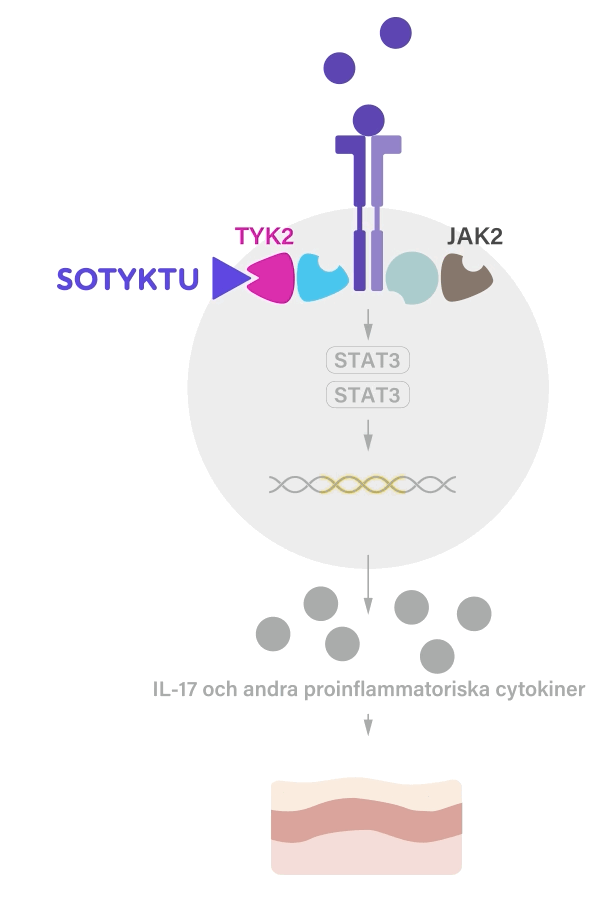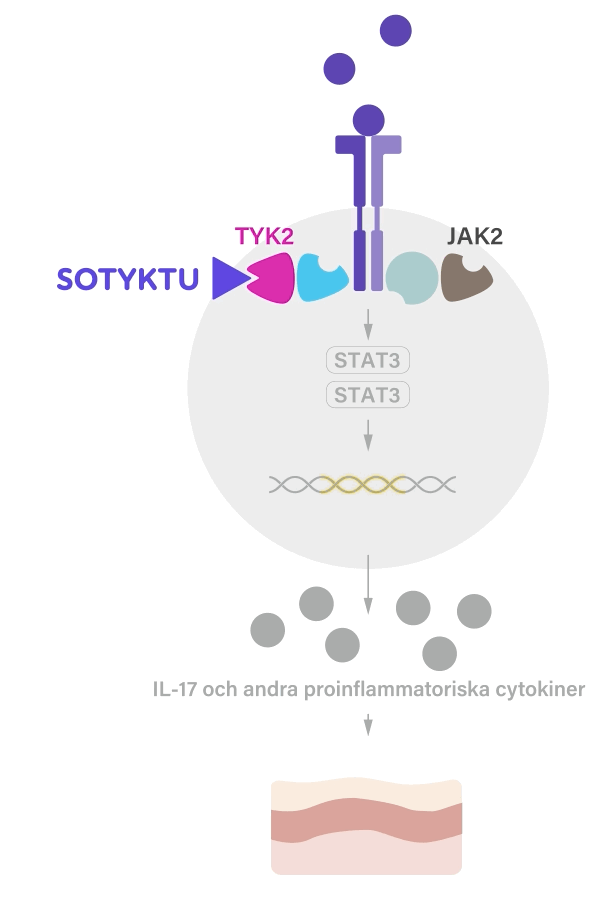
SOTYKTU fungerar genom att selektivt blockera aktiviteten hos enzymet TYK2 (tyrosinkinas 2), som är involverad i inflammationsprocesser. Genom att minska aktiviteten av detta enzym kan SOTYKTU hjälpa till att kontrollera den inflammation som förknippas med psoriasis och bidrar därmed till att minska symtom som t.ex. klåda, smärta och sveda.1
SOTYKTU binder till den regulatoriska domänen av TYK2 vilket leder till en allosterisk hämning av TYK2 aktivering och dess nedströmsfunktioner i cellen. TYK2 förmedlar signalering av IL-23, IL-12 och typ 1-IFN, vilka är naturligt förekommande cytokiner inblandade i det inflammatoriska svaret och immunsvaret.1-3