Förkortningar: BID: twice a day; BSA: Body Surface Area; PASI: psoriasis area and severity index; POETYK-PSO: Program fOr Evaluation of TYK2 inhibitor psoriasis; sPGA: Static Physicians Global Assessment; ss PGA skalp-specifik Physicians Global Assessment; QD: once daily, daglig endos.
Referenser: 1. Armstrong AW, Gooderham M, Warren RB, et al. Deucravacitinib versus placebo and apremilast in moderate to severe plaque psoriasis: Efficacy and safety result from the 52-week, randomized, double-blinded, placebo-controlled phase 3 POETYK PSO-1 trial. J Am Acad Dermatol. 2023;88(1):29-39.
2. Strober B, Thaçi D, Sofen H, et al. Deucravacitinib versus placebo and apremilast in moderate to severe plaque psoriasis: Efficacy and safety results from the 52-week, randomized, double-blinded, phase 3 Program fOr Evaluation of TYK2 inhibitor psoriasis second trial. J Am Acad Dermatol. 2023;88(1):40-51.
3. Armstrong AW, et al. Oral presentation at the EADV Annual Meeting; 11-14 October 2023; Berlin, Germany. Presentation FC.02.7.
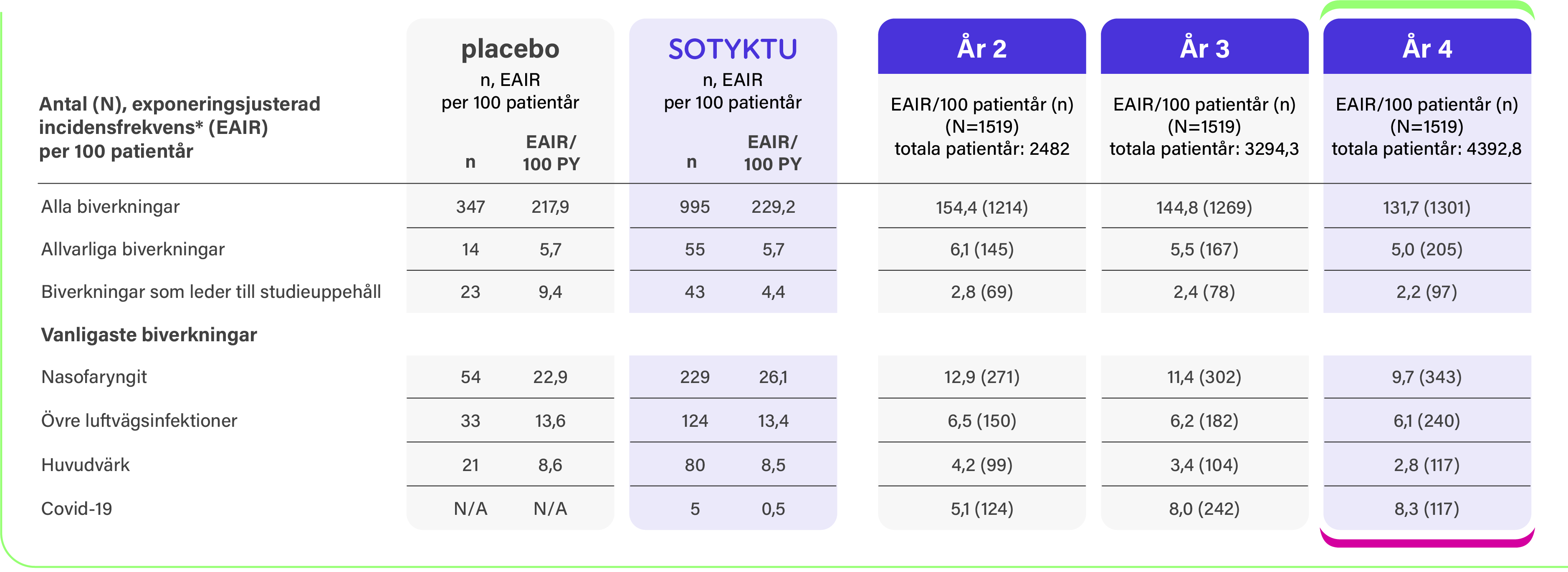
6. Armstrong AW, et al. Deucravacitinib in plaque psoriasis: 4-year safety and efficacy results from the phase 3 POETYK PSO-1, PSO-2, and LTE trials. Muntlig presentation vid: European Academy of Dermatology & Venereology Symposium; 16-18 Maj 2024; St. Julians, Malta.
7. Armstrong AW, Gooderham M, Warren RB, et al. Deucravacitinib versus placebo and apremilast in moderate to severe plaque psoriasis: Efficacy and safety result from the 52-week, randomized,double-blinded, placebo-controlled phase 3 POETYK PSO-1 trial. J Am Acad Dermatol. 2023;88(1):29-39.
8. Strober B, Thaçi D, Sofen H, et al. Deucravacitinib versus placebo and apremilast in moderate to severe plaque psoriasis: Efficacy and safety results from the 52-week, randomized, double-blinded, phase 3 Program fOr Evaluation of TYK2 inhibitor psoriasis second trial. J Am Acad Dermatol. 2023;88(1):40-51.