▼Detta läkemedel är föremål för utökad övervakning.
SOTYKTU® (deukravacitinib), Rx (F), 6 mg filmdragerade tabletter. Immunsuppressivt medel, ATC-kod: L04AA56
Villkor: Subventioneras endast för patienter som fått otillräcklig effekt av konventionell och biologisk systemisk behandling, eller där detta inte är lämpligt.
Indikation: SOTYKTU är indicerat för behandling av måttlig till svår plackpsoriasis hos vuxna som behöver systemisk behandling.
Kontraindikationer: Kliniska relevanta aktiva infektioner (t.ex. aktiv tuberkulos)
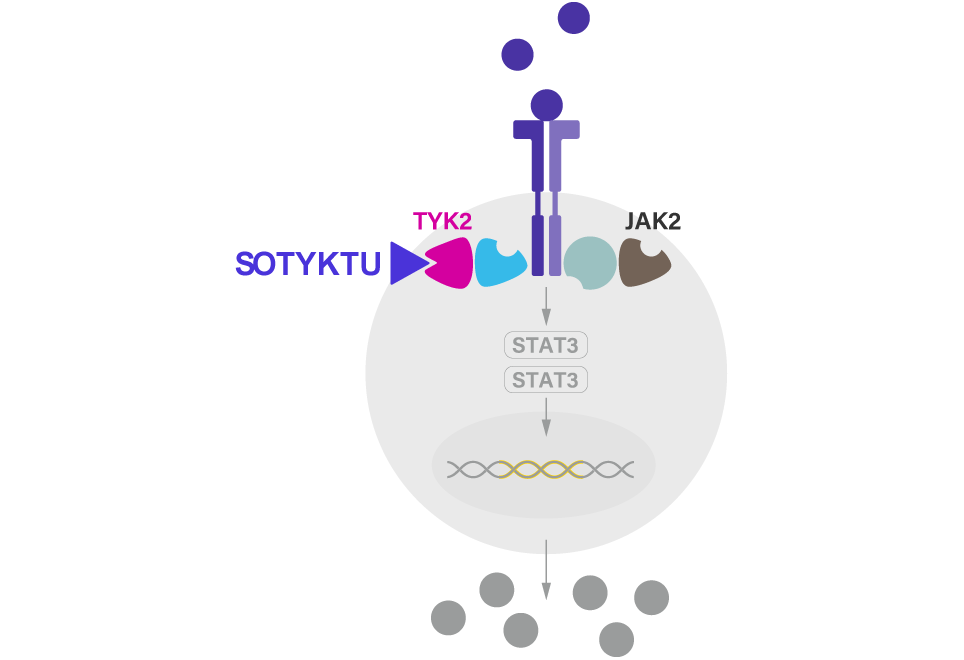
Varningar och försiktighet: Infektioner: Deukravacitinib kan öka risken för infektioner. Behandling med deukravacitinib ska inte inledas hos patienter med klinisk relevant aktiv infektion förrän infektionen har läkt ut eller behandlats. Tuberkulos: Innan behandling med deukravacitinib påbörjas ska patienterna utvärderas med avseende på tuberkulosinfektion. Behandling mot tuberkulos ska övervägas hos patienter med latent eller aktiv tuberkulos i anamnesen för vilka adekvat behandling inte kan bekräftas. Maligniteter: Maligniteter, inklusive lymfom och icke-melanom hudcancer, har observerats i kliniska studier. Kardiovaskulära biverkningar: Tillgängliga data från kliniska studier visar inte på någon ökad risk för MACE, DVT och LE vid behand-ling med deucravacitinib. För maligniteter och kardiovaskulära biverkningar: Det är inte känt huruvida hämning av tyrosinkinas 2 (TYK2) kan vara kopplad till biverkningarna av januskinas (JAK)-hämning med avseende på maligniteter och allvarliga kardiovaskulära biverkningar. Långsiktiga säkerhetsutvärderingar pågår. Riskerna och fördelarna med behandling med deukravacitinib ska övervägas innan behandling startas på patienter. Vacciner: Innan behandling med deukravacitinib påbörjas bör alla för åldern lämpliga vaccinationer ges enligt gällande vaccinationsriktlinjer. Levande vacciner ska undvikas till patienter som behandlas med deukravacitinib. Svaret på levande eller icke-levande vacciner har inte utvärderats.
Graviditet: Det finns begränsad mängd data från användningen av deukravacitinib hos gravida kvinnor. Som en försiktighetsåtgärd bör man undvika användning av deukravacitinib under graviditet.
Förpackningar: Kartonger med 28 filmdragerade tabletter. Blisterkartor med 14 tabletter (kalenderblister).
Övrig information: För pris och ytterligare information, se www.fass.se. Texten är baserad på produktresumé 20 december 2023.
Bristol Myers Squibb, tel. 08 704 71 00, www.bms.com/se